1. 无背景无条带

原因分析:
如果 marker 正常,其他位置没有条带,最可能是一抗加成其他抗体,或者二抗种属加错了,比如兔的加成鼠的。
解决办法:
- 目的蛋白完全无信号,但同时做的内参是正常的,那么大部分情况是一抗抗体失效或用错二抗。
- 目的蛋白和内参均无信号,则考虑是否发光液失效。如果膜上没有 marker 则为转膜失败。
- 如果中间出现了细微条带,可能是蛋白上样量太少,或一抗浓度过低。
2. 高背景

原因分析:
封闭不充分,一抗浓度过高,洗膜时间和次数不够。
解决办法:
降低一抗浓度,增加洗膜时间和次数。
- 一抗/二抗浓度配比不合适:杂带多,大概率是抗体特异性不好,也有可能抗体浓度太高,可尝试降低一抗浓度进行实验。
- 封闭液问题:配制封闭液所用的脱脂奶粉应选用无防腐剂实验专用脱脂奶粉。
- 洗膜不充分:洗膜按规定来 5min*5 次或 10min*3 次。
3. 非特异性条带
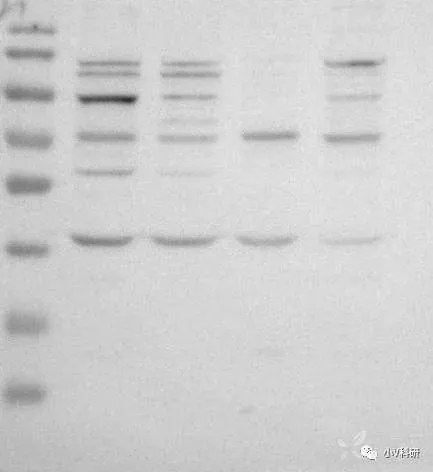
原因分析:
一抗非特异性与蛋白结合。
解决办法:
更换一抗。此种情况绝大多数是因为一抗不好,你无法判断哪一条是目的条带。如果实在没有更好的抗体,建议采用阴性对照和阳性对照来确定上述哪个条带是目的条带。当然也有一种很小几率的可能是一抗浓度太高引起的非特异性结合
4. 条带中出现边缘规则的白圈
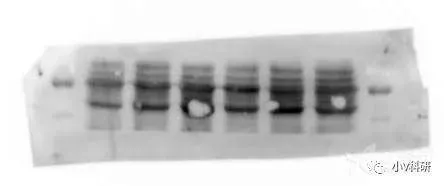
原因分析:
- 电转中膜与胶之间存在气泡。
- 可能是转膜过程烧膜了,特别是半干转操作不当导致烧膜。
- 转膜时温度过高产生气泡。
- 印迹膜活化不佳。
解决办法:
- 注意排清气泡。
- 优化实验条件或使用湿转法转膜。
- 把整个转膜装置放于 -20 度冰箱中电转。
- 确保印迹膜完全活化。
5. 出现黑点和黑斑
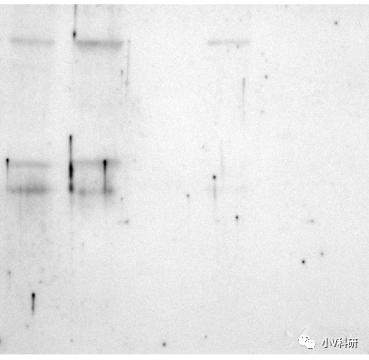
原因分析:
- 一般出现这种情况可能是封闭液溶解不完全或封闭液存放时间太久(长菌)。
- 膜上其他部位与一抗或二抗非特异性结合。
解决办法:
- 过滤封闭液或选用其他类型封闭液。
- 与其他品牌已验证过好用的抗体处理相同样本,作比较,看是否还有斑点。
6. 条带拖尾
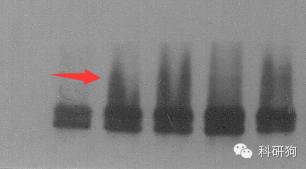
原因分析:
一抗浓度太高和时间太长。
解决办法:
根据情况调整一抗浓度,时间也可缩短。
7. 出现非均一性背景
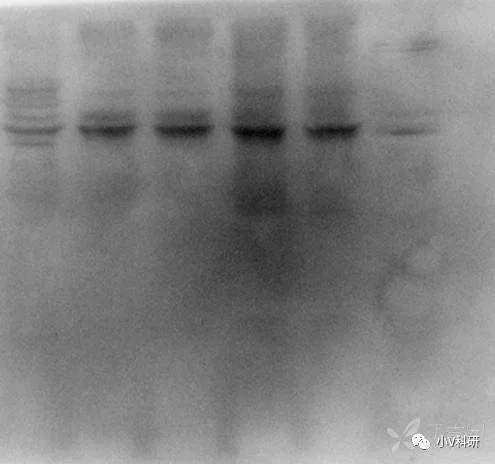

原因分析:
膜可能在孵育或洗涤过程中干过。
解决办法:
每一步的操作过程中,注意不要让膜干。封闭时洗一抗洗二抗,以及发光时都应时刻注意切记蛋白面风干,一旦风干很可能会导致这个结果。
8. 某个条带变形
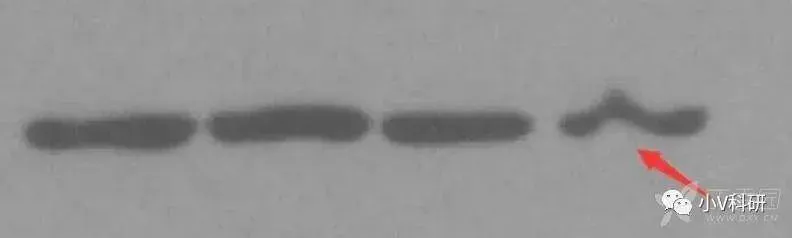
原因分析:
SDS-PAGE 胶中存在气泡或某不溶性颗粒。
解决办法:
配胶过程中,要注意不要使用无杂质液体
9. 条带不均一,哑铃型
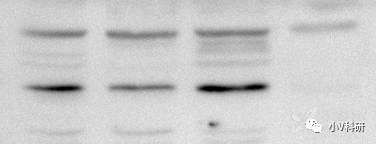

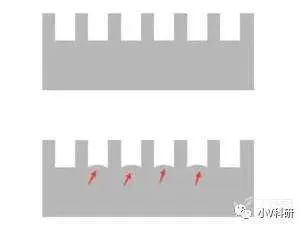
原因分析:
- 配置胶凝固不均一。
- 转膜问题:转膜夹子不紧,转膜滤纸或海绵由于使用消耗,滤纸及海绵变薄,海绵弹性不足。
- 一抗孵育问题:抗体孵育不充分或抗体稀释液放入过少。
解决办法:
- 把胶配好,不合格的胶坚决不用。
- 及时更换转膜滤纸和海绵。
- 增大抗体稀释液用量、更换跷跷板类型的摇床将膜完全进入抗体稀释液中。
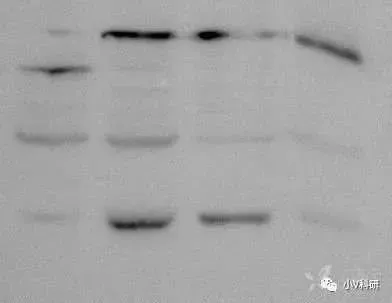
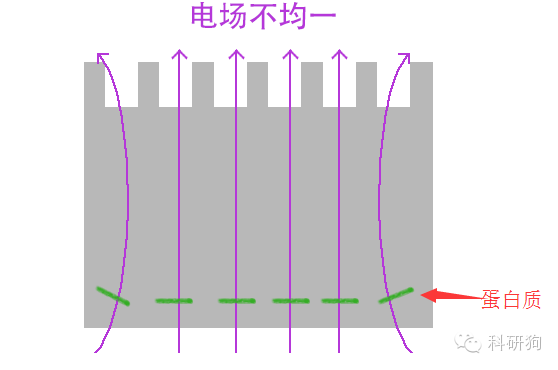
10. 最边缘条带弯曲
原因分析:
电泳电流不均一,玻璃板右下侧有缺口。
解决办法:
换用新的玻璃板,不使用两边的两孔。上样最好在胶的中间,这样电场均一。
11. 条带笑脸,marker正常
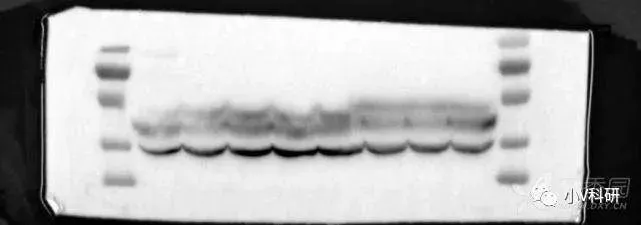
一般来说笑脸问题首先考虑电泳环节,多半是凝胶没凝固好。但上图 marker 却异常整齐,笑脸条带整齐地手拉手,这就不是凝胶问题导致的。
原因分析:
- loading buffer 失效,导致样品变性失败。
- 上样量过大或样品杂质多。
- 电压太高。
解决办法:
- 更换 loading buffer。
- 超滤样品或降低上样量。
- 降低电压。
12. 曝光结果条带扭曲
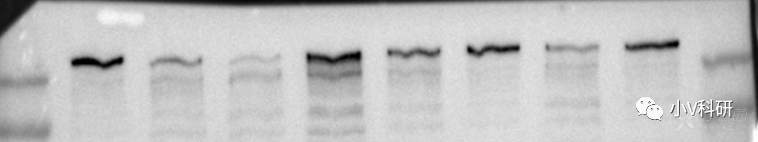
原因分析:
转膜问题,对于分子量稍大的蛋白,转膜时间过长,转膜装置产热过多,无法维持转膜时的低温环境,造成条带扭曲。
解决办法:
建议在条件允许的情况下直接在 4℃ 中进行转膜,将冰更换为冰水混合物,及时更换转膜液并将转膜液放入 4℃ 中提前预冷。
对于大分子量的抗体,跑胶前可以先把样本煮一下,然后稍微离心一下,同样也可以改善这种情况。
13. 条带中间出现白色(反白)

原因:中心部位高浓度HRP把底物消耗过快,中间部位底物消耗结束之后就不发光了
解决办法:降低蛋白量,降低一抗和二抗的浓度。
经验:如果你足够迅速,可以在中间部位底物消耗之前就把X光片给定影出来,但是时间很难把握,建议还是从降低蛋白量,降低一抗二抗浓度入手。
参考来源:https://www.dxy.cn/bbs/newweb/pc/post/48015477;https://www.sohu.com/a/228368471_419916



